Изотопы водорода
Водород имеет три основных изотопа: протий (1H), дейтерий (2H) и тритий (3H). Эти изотопы образуются в природе естественным образом. Протий и дейтерий стабильны. Тритий радиоактивен и имеет период полураспада около 12 лет. Ученые создали еще четыре изотопа водорода (4H -7 H), но эти изотопы очень нестабильны и не существуют в природе.
Основные изотопы водорода уникальны, потому что это единственные изотопы, у которых есть название. Эти названия используются и сегодня. Дейтерий и тритий иногда получают собственные символы - D и T. Однако Международному союзу теоретической и прикладной химии не очень нравятся эти названия, хотя они часто используются. Есть и другие изотопы, которые имели собственные названия, когда ученые изучали радиоактивность. Но сегодня их названия уже не используются.
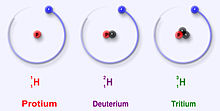
Три наиболее стабильных изотопа водорода
Протий (водород-1)
Протий - самый распространенный изотоп водорода. Он составляет более 99,98% всего водорода во Вселенной. Он назван протием, потому что в его ядре только один протон. Атомная масса протия составляет 1,00782504(7) u. Символ протия - 1H.Протон протия никогда не распадался в ходе наблюдений, поэтому ученые считают, что протий является стабильным изотопом. Новые теории физики частиц предсказывают, что протон может распадаться, но этот распад происходит очень медленно. Считается, что период полураспада протона составляет 1036 лет. Если распад протона - это правда, то все остальные ядра, о которых говорят, что они стабильны, на самом деле стабильны только по наблюдениям, то есть выглядят так, как будто они стабильны. Недавние эксперименты показали, что если распад протона действительно происходит, то период его полураспада составляет 6,6 × 1033 лет.
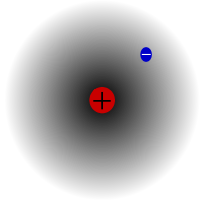
Протий - самый распространенный изотоп водорода. Его особенность заключается в том, что это единственный изотоп, не имеющий нейтрона.
Дейтерий (водород-2)
Дейтерий, или 2H, или иногда D, является еще одним стабильным изотопом водорода. Этот изотоп имеет один протон и один нейтрон. Он составляет около 0,0026 - 0,0184% всех атомов водорода на Земле. Дейтерия меньше в газообразном водороде на Земле и больше в морской воде (0,015% или 150 ppm). Дейтерий не радиоактивен и не вредит живым существам. Дейтерий также может образовывать молекулы воды. Вода, содержащая дейтерий вместо протия, называется тяжелой водой.
Тритий (водород-3)
Тритий (3H) является наиболее стабильным радиоизотопом водорода. То есть из всех радиоактивных изотопов водорода тритий наименее радиоактивен. В его ядре есть протон и 2 нейтрона. Тритий распадается посредством бета-минус распада и превращается в гелий-3. Его период полураспада составляет 12,32 года.Тритий образуется естественным образом в результате взаимодействия газов в верхних слоях атмосферы с космическими лучами. Он также образуется во время испытаний ядерного оружия. Тритий и дейтерий используются в ядерном синтезе D-T в звездах для выделения большого количества энергии.
Вопросы и ответы
В: Сколько существует основных изотопов водорода?
О: Существует три основных изотопа водорода: протий, дейтерий и тритий.
В: Являются ли протий и дейтерий стабильными изотопами?
О: Да, протий и дейтерий являются стабильными изотопами.
В: Каков период полураспада трития?
О: Тритий радиоактивен и имеет период полураспада около 12 лет.
В: Сколько еще изотопов водорода было создано учеными?
О: Ученые создали четыре других изотопа водорода: от 4H до 7H.
В: Существуют ли эти четыре дополнительных изотопа водорода в природе?
О: Нет, эти изотопы очень нестабильны и не существуют в природе.
В: Что делает основные изотопы водорода уникальными?
О: Основные изотопы водорода уникальны, потому что это единственные изотопы, у которых есть название.
В: Имеют ли дейтерий и тритий свои собственные символы?
О: Да, дейтерий и тритий иногда получают свои собственные символы: D и T. Однако Международный союз теоретической и прикладной химии не очень любит эти названия, хотя они часто используются.
искать