Гальванический элемент
Химический элемент преобразует химическую энергию в электрическую. Большинство батарей являются химическими элементами. Внутри батареи происходит химическая реакция, которая вызывает электрический ток.
Существует два основных типа батарей - перезаряжаемые и неперезаряжаемые.
Батарея, которая не перезаряжается, будет давать электричество до тех пор, пока химические вещества в ней не будут израсходованы. Тогда она больше не пригодится. Это можно по праву назвать "использовать и выбросить".
Аккумулятор можно зарядить, пропустив через него электрический ток в обратном направлении; затем его можно снова использовать для производства большего количества электроэнергии. Гастон Плант, французский ученый, изобрел эти аккумуляторы в 1859 году.
Батарейки бывают разных форм и размеров, от очень маленьких, используемых в игрушках и фотоаппаратах, до автомобильных и даже более крупных. Для подводных лодок требуются очень большие батареи.
Типы химических элементов
- Простая клетка
- Сухая камера
- Влажная камера
- Топливный элемент
- Солнечная батарея
- Электрический элемент
Электрохимические ячейки
Чрезвычайно важный класс реакций окисления и восстановления используется для получения полезной электрической энергии в батареях. Простой электрохимический элемент может быть изготовлен из металлов меди и цинка с растворами их сульфатов. В процессе реакции электроны могут передаваться от цинка к меди по электропроводящему пути в виде полезного электрического тока.
Электрохимический элемент может быть создан путем помещения металлических электродов в электролит, где в результате химической реакции либо используется, либо генерируется электрический ток. Электрохимические элементы, генерирующие электрический ток, называются вольтовыми или гальваническими элементами, а обычные батареи состоят из одного или нескольких таких элементов. В других электрохимических элементах электрический ток, подаваемый извне, используется для запуска химической реакции, которая не происходит спонтанно. Такие элементы называются электролитическими.
Вольтаические элементы
Электрохимическая ячейка, вызывающая протекание внешнего электрического тока, может быть создана с использованием любых двух различных металлов, поскольку металлы различаются по своей склонности терять электроны. Цинк охотнее теряет электроны, чем медь, поэтому помещение цинка и меди в растворы их солей может вызвать поток электронов через внешний провод, ведущий от цинка к меди. Поскольку атом цинка отдает электроны, он становится положительным ионом и переходит в водный раствор, уменьшая массу цинкового электрода. На стороне меди два полученных электрона позволяют ей превратить ион меди из раствора в незаряженный атом меди, который оседает на медном электроде, увеличивая его массу. Эти две реакции обычно записываются следующим образом
Zn(s) --> Zn2+(aq) + 2e
Cu2+(aq) + 2e- --> Cu(s)
Буквы в скобках напоминают, что цинк переходит из твердого состояния (s) в водный раствор (aq) и наоборот для меди. В языке электрохимии принято называть эти два процесса "полуреакциями", происходящими на двух электродах.
| Zn(s) -> Zn2+(aq) + 2e |
|
| Cu2+(aq) + 2e- -> Cu(s) |
Для того чтобы вольтов элемент продолжал вырабатывать внешний электрический ток, необходимо движение ионов сульфата в растворе справа налево, чтобы уравновесить поток электронов во внешней цепи. Сами ионы металла не должны перемещаться между электродами, поэтому какая-то пористая мембрана или другой механизм должны обеспечивать избирательное перемещение отрицательных ионов в электролите справа налево.
Для того чтобы заставить электроны перемещаться от цинкового электрода к медному, требуется энергия, а количество энергии на единицу заряда вольтова элемента называется электродвижущей силой (ЭДС) элемента. Энергия на единицу заряда выражается в вольтах (1 вольт = 1 джоуль/кулон).
Очевидно, что для получения энергии из ячейки необходимо получить больше энергии, выделяющейся при окислении цинка, чем требуется для восстановления меди. Ячейка может дать конечное количество энергии из этого процесса, процесс ограничен количеством материала, доступного либо в электролите, либо в металлических электродах. Например, если на стороне меди имеется один моль сульфат-ионов SO42-, то процесс ограничивается переносом двух молей электронов по внешней цепи. Величина электрического заряда, содержащегося в моле электронов, называется постоянной Фарадея и равна числу Авогадро, умноженному на заряд электрона:
Постоянная Фарадея = F = ANe = 6,022 x 1023 x 1,602 x 10-19 = 96,485 Кулон/моль
Выход энергии из вольтаического элемента определяется напряжением элемента, умноженным на количество молей перенесенных электронов, умноженное на постоянную Фарадея.
Выход электрической энергии = nFE
ЭДС ячейки Ecell может быть предсказана на основе стандартных электродных потенциалов для двух металлов. Для элемента цинк/медь при стандартных условиях расчетный потенциал элемента составляет 1,1 вольт.
Простая клетка
Простая ячейка обычно состоит из пластин меди (Cu) и цинка (Zn) в разбавленной серной кислоте. Цинк растворяется, и на медной пластине появляются пузырьки водорода. Эти пузырьки водорода препятствуют прохождению тока, поэтому простую ячейку можно использовать только в течение короткого времени. Чтобы обеспечить постоянный ток, необходим деполяризатор (окислитель) для окисления водорода. В элементе Даниэля деполяризатором является сульфат меди, который обменивает водород на медь. В батарее Лекланша деполяризатором является диоксид марганца, который окисляет водород до воды.
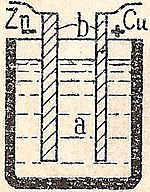
Простая клетка
Даниил клетка
Английский химик Джон Фредерик Дэниелл в 1836 году разработал вольтаический элемент, в котором использовались цинк и медь и растворы их ионов.
Ключ
- Цинковый стержень = отрицательная клемма
- 2HSO4 = электролит разбавленной серной кислоты
- Пористый горшок разделяет две жидкости
- CuSO4 = деполяризатор сульфата меди
- Медный горшок = положительная клемма
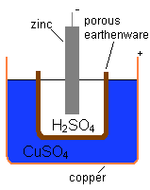
Диаграмма клетки Даниэля
Вопросы и ответы
В: Что такое химическая ячейка и каково ее назначение?
О: Химический элемент - это устройство, которое преобразует химическую энергию в электрическую. Его назначение - производить электрический ток посредством химической реакции.
В: Что такое большинство батареек?
О: Большинство батареек - это химические элементы.
В: Что происходит внутри батареи, что вызывает протекание электрического тока?
О: Внутри батареи происходит химическая реакция, которая вызывает протекание электрического тока.
В: Сколько существует типов батареек и какие они бывают?
О: Существует два основных типа батарей - перезаряжаемые и неперезаряжаемые.
В: Что происходит, когда неперезаряжаемая батарея израсходована?
О: Неперезаряжаемая батарейка будет давать электричество до тех пор, пока химические вещества в ней не израсходуются. Тогда она становится бесполезной и ее можно выбросить.
В: Кто и когда изобрел перезаряжаемые батареи?
О: Аккумуляторные батареи были изобретены Гастоном Плантом, французским ученым, в 1859 году.
В: Могут ли батарейки быть разных размеров и что является примером устройства, которому требуется большая батарейка?
О: Да, батарейки могут быть разных форм и размеров. Примером устройства, которому требуется большая батарея, является подводная лодка.
искать