Ковалентная связь
Ковалентные связи - это химические связи между двумя атомами неметалла. Примером является вода, где водород (H) и кислород (O) связи вместе, чтобы сделать (H2O). Полная внешняя оболочка обычно имеет восемь электронов, или два в случае водорода или гелия. Валансные электроны - это электроны, относительно свободно удерживаемые во внешней оболочке атома. Структура электронных оболочек определяется квантовой механикой).
Количество электронов в атоме определяется количеством протонов в атоме. Электроны вращаются вокруг атомных ядер, и они подобны нечетким орбитальным путям вокруг атомного ядра. Первый слой имеет до двух электронов. Последующие слои обычно содержат до восьми. Ковалентные связи образуются атомами, разделяющими валентные электроны.
Если, например, в атоме было девять электронов, то первые два орбиты очень близко к ядру, а следующие семь - чуть дальше. Внешние семь электронов удерживаются менее плотно, чем внутренние два электрона, потому что они находятся дальше от положительно заряженного ядра. Если этот атом приблизится к другому атому с свободно удерживаемым электроном во внешней оболочке, то для свободно удерживаемого электрона станет доступной новая орбита. Эта новая электронная орбита привязана к обоим атомным ядрам и имеет более низкий энергетический уровень, чем первоначальная электронная орбита. Электрон может спонтанно перепрыгнуть на нее и испустить фотон с избыточной энергией. Теперь у нас есть электрон, орбитальный как для обоих атомов, что приводит к атому, который обеспечил электрону малый нетто-положительный заряд, так и для другого атома с малым нетто-отрицательным зарядом. Теперь оба атома удерживаются вместе электромагнитной силой притяжения между положительным и отрицательным зарядами. Это называется ковалентной связью. Чтобы разорвать эту связь, требуется то же количество энергии, которое было высвобождено при ее формировании.
Молекула воды состоит из одного атома кислорода и двух атомов водорода, удерживаемых вместе ковалентной связью. В этом случае атом кислорода разделяет один электрон с каждым атомом водорода. Это означает, что атомы кислорода имеют малый нетто-положительный заряд, а атом водорода имеет малый нетто-отрицательный заряд. В результате этого атомы кислорода и водорода притягиваются друг к другу под действием электромагнитной силы. Поэтому молекула воды является полярной молекулой: ее заряд распределен неравномерно.
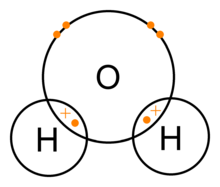
Ковалентные связи воды (H2O)
Типы ковалентной связи
Атомные орбитали (за исключением орбиталей s) образуют различные типы ковалентных связей:
- Облигации Sigma (σ) являются самыми сильными ковалентными облигациями. Они имеют лобовое наложение орбиталей на два разных атома. Обычно одной связью является связь σ.
- Связи Pi (π) слабее и обусловлены боковым перекрытием между орбитами p (или d).
- Двойная связь между двумя данными атомами имеет один σ и один π, и
- у тройной облигации есть одна облигация σ и две облигации π.
Ковалентные облигации слабее ионных и имеют более низкую температуру плавления. Кроме того, они, как правило, являются плохими проводниками электричества и тепла.
Длина облигаций
В химии длина связи является мерой размера ковалентной связи. Поскольку молекулы очень маленькие, они измеряются в пикометрах, или примерно на миллионной части миллиардной части метра.
Химия молекул объясняется в основном их связями, а их связь обусловлена структурой электронов.
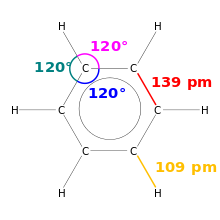
Рисование бензола. Показаны длины сцепления и углы сцепления.
Связанные страницы
- Valency
Вопросы и ответы
В: Что такое ковалентная связь?
О: Ковалентная связь - это химическая связь между двумя неметаллическими атомами, при которой атомы имеют общие валентные электроны. В результате образуется электронная орбиталь, которая связана с обоими атомными ядрами и имеет более низкий энергетический уровень, чем исходная электронная орбиталь. В результате атом, отдавший электрон, имеет небольшой чистый положительный заряд, а другой атом - небольшой чистый отрицательный заряд, которые удерживаются вместе электромагнитной силой притяжения между положительными и отрицательными зарядами.
В: Сколько электронов обычно имеет атом в своей внешней оболочке?
О: Внешняя оболочка атома обычно содержит до восьми электронов, или два электрона в случае водорода или гелия.
В: Что определяет количество электронов в атоме?
О: Количество электронов в атоме определяется количеством протонов в атоме.
В: Как образуются ковалентные связи?
О: Ковалентные связи образуются, когда атомы сближаются друг с другом, и один свободно удерживаемый электрон из одного атома перескакивает на новую орбиталь, которая связана с обоими атомными ядрами с более низким энергетическим уровнем, чем раньше. В результате один атом имеет небольшой чистый положительный заряд, а другой - небольшой чистый отрицательный заряд, что создает между ними электромагнитную силу притяжения.
В: К какому типу молекул относится вода?
О: Молекулы воды состоят из одного атома кислорода и двух атомов водорода, удерживаемых вместе ковалентными связями, что делает ее полярной молекулой, поскольку ее заряд распределен неравномерно.
В: Где электроны вращаются вокруг атомных ядер?
О: Электроны вращаются вокруг атомных ядер по нечетким орбитальным траекториям.
искать