Водородный показатель
pH - это шкала кислотности от 0 до 14. Он говорит о том, насколько кислым или щелочным является вещество. Более кислые растворы имеют более низкий pH. Больше щелочных растворов имеют более высокий pH. Вещества, не являющиеся кислыми или щелочными (т.е. нейтральные растворы), обычно имеют pH 7. Кислоты имеют pH менее 7. Щелочи имеют рН, превышающий 7.
pH является мерой концентрации протонов (Н+) в растворе. S.P.L. Sørensen ввел это понятие в 1909 году. p обозначает немецкий потенц, означающий мощность или концентрацию, а H - ион водорода (H+).
Наиболее распространенная формула для вычисления pH:
pH = - журнал 10 [ H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}^{+}\right] }
[H+] указывает на концентрацию ионов H+ (также написано [H3O+], равное концентрация ионов гидрония), измеренную в кротах на литр (также известную как молярность).
Однако на самом деле правильное уравнение:
pH = - журнал 10 [ a H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}
где H + {\displaystyle a_{\mathrm {H^{+}} }} 
Большинство веществ имеют pH в диапазоне от 0 до 14, хотя чрезвычайно кислые или щелочные вещества могут иметь pH < 0, или pH > 14.
Щелочные вещества имеют вместо ионов водорода концентрацию ионов гидроксида (OH-).
pH-индикаторы
Некоторые красители меняют цвет в зависимости от того, находятся ли они в растворе кислоты или в щелочном растворе. pH-индикатор - это химическое соединение, добавленное в небольшом количестве в раствор для того, чтобы был виден pH (кислотность или основность) раствора. pH-индикатор - это химический детектор ионов гидрония (H3O+) или водорода (H+). Обычно индикатор вызывает изменение цвета раствора в зависимости от pH.
Типичными показателями являются фенолфталеин, метил-оранжевый, метил-красный, бромотимол-синий и тимол-синий. Каждый из них меняет цвет в разных точках шкалы pH, и может использоваться вместе как универсальный индикатор.
Другой способ - использование лакмусовой бумажки, которая основана на натуральных показателях pH. Бумага может подсказать вам, насколько сильным является химикат, будь то более сильная кислота или более прочная основа.
Некоторые общие значения рН
| рН | |
| Аккумуляторная кислота | 0 |
| желудочная кислота | 1.0 |
| лимонный сок | 2.4 |
| Кола | 2.5 |
| Кислородная вода | 2.5 - 3.0 |
| Уксус | 3.0 |
| Апельсиновый или яблочный сок | 3.0 |
| Пиво | 4.5 |
| Кофе | 5.0 |
| Молоко | 6.6 |
| 7.0 | |
| Кровь | 7.35 - 7.45 |
| Простой шампунь | 8.0 |
| морская вода | 8.0 |
| Постоянная волна | 8.5 - 9.2 |
| Мыло для рук | 9.0 - 10.0 |
| краска для волос | 9.5 - 10.5 |
| Волшебная прямая | 11.5 |
| Бытовой аммиак | 11.5 |
| Отбеливатель | 12.3 |
| каустическая сода | 12.7 |
| Бытовая щёлочь | 13.5 |
| Сливной очиститель | 14 |
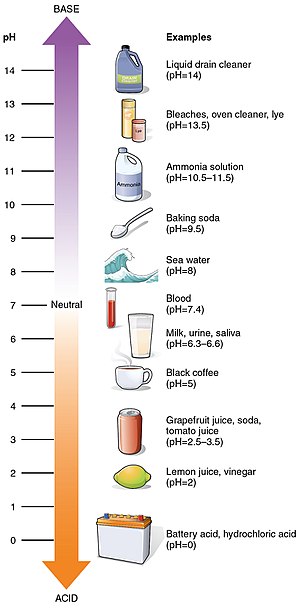
значения рН некоторых распространённых веществ
Нейтрализация
Нейтрализация может быть суммирована уравнением:
H+
+ ОН-
→ H
2O
Связанные страницы
Вопросы и ответы
В: Что такое pH?
О: pH - это шкала кислотности от 0 до 14, которая измеряет концентрацию протонов (H+) в растворе. Она показывает, насколько кислотным или щелочным является вещество, при этом более кислые растворы имеют более низкий pH, а более щелочные - более высокий. Нейтральные растворы обычно имеют pH 7.
В: Кто ввел понятие pH?
О: С.П.Л. Сёренсен ввел это понятие в 1909 году.
В: Что означает буква "p" в слове "pH"?
О: Буква "p" означает немецкое слово potenz, то есть сила или концентрация.
В: Как Вы рассчитываете pH?
О: Наиболее распространенная формула для расчета pH - это взять отрицательный логарифм 10-кратной концентрации ионов H+ (также пишется [H3O+], что указывает на равные концентрации ионов гидрония), измеренной в молях на литр (или молярности). Однако существует также уравнение, учитывающее активность, а не только концентрацию, которое может давать значения, отличные от более распространенной формулы, в зависимости от ситуации.
В: Какой диапазон имеет большинство веществ на шкале pH?
О: Большинство веществ имеют pH в диапазоне от 0 до 14, хотя чрезвычайно кислые или щелочные вещества могут иметь значение вне этого диапазона (меньше 0 или больше 14).
В: Чем щелочные вещества отличаются от кислых по шкале pH? О: Щелочные вещества имеют более высокие значения на шкале из-за концентрации в них гидроксид-ионов (OH-), а не ионов водорода, как у кислот.
искать
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}](https://www.alegsaonline.com/image/093977a79b6a17e02db4699475930e48c05d6468.svg)
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}](https://www.alegsaonline.com/image/7a631c4037415f3d4483a6cb07e69858b64890fc.svg)