Хелетропические реакции
Хелетропические реакции - это тип перициклической реакции, в которой один атом одного из реагентов получает две новые связи. Перициклическая реакция - это реакция, в которой участвует переходное состояние с циклическим набором атомов и соответствующим циклическим набором взаимодействующих орбиталей. В этом циклическом массиве происходит реорганизация σ- и π-связей.
Хелетропные реакции являются подклассом циклоприсоединений. Отличительной особенностью хелетропных реакций является то, что в одном из реагентов обе новые связи образуются с одним и тем же атомом. Несколько примеров показаны справа на рисунке 1. В первом случае единственным атомом является атом углерода в карбонильной группе. Этот атом углерода в итоге превращается в монооксид углерода. В итоге к одному атому образуются две новые связи. Первые два примера известны как "хелетропные экструзии", поскольку в ходе реакции выделяется небольшая стабильная молекула. Движущей силой этих реакций часто является энтропийная выгода от высвобождения газа (например, CO или N2).

Рисунок 1. Перициклические реакции
Теоретический анализ
Благодаря геометрии молекул, участвующих в хелетропических реакциях, они подтверждают ряд предсказаний, сделанных химиками-теоретиками. Хелетропические реакции подтверждают сохранение симметрии молекулярных орбиталей.
В перициклическом переходном состоянии маленькая молекула отдает два электрона кольцу. Реакцию можно объяснить двумя возможными геометриями. Маленькая молекула может подходить линейно или нелинейно. При линейном подходе электроны на орбитали маленькой молекулы направлены прямо на π-систему большой молекулы. При нелинейном подходе орбиталь приближается под немного смещенным углом. Способность π-системы вращаться при приближении маленькой молекулы имеет решающее значение для образования новых связей. Направление вращения будет отличаться в зависимости от того, сколько π-электронов находится в системе. Ниже показана диаграмма двухэлектронного фрагмента, приближающегося к четырехэлектронной π-системе с помощью пограничных молекулярных орбиталей. Вращение будет диротационным, если маленькая молекула приближается линейно, и конротационным, если молекула приближается нелинейно. Дисротационное и конротационное вращения говорят о том, как вращаются связи в π-системе. Дисротационный означает противоположные направления, а конротационный - одинаковые. Это также показано на диаграмме ниже.
Используя правило Геккеля, можно определить, является ли π-система ароматической или антиароматической. Если система ароматическая, то линейные подходы используют диротационное движение, а нелинейные подходы - конротационное движение. С антиароматической системой все наоборот. Линейные подходы будут использовать конротационное движение, а нелинейные подходы - диротационное движение.
Хелетропические реакции с участием SO2
Термодинамика
Когда диоксид серы реагирует с бутадиеном и изопреном, получаются два разных продукта. Механизм реакции будет определять, что получается. Возможны как кинетический, так и термодинамический продукт. Из термодинамического продукта получается больше, чем из кинетического. Кинетический продукт образуется в результате реакции Дильса-Альдера, а в результате хелетропической реакции образуется более термодинамически стабильный продукт. Хелетропный путь используется чаще, поскольку он приводит к образованию более стабильного аддукта с пятичленным кольцом. Приведенная ниже схема показывает разницу между двумя продуктами. Путь слева показывает термодинамический продукт, а путь справа - кинетический. Суарес и Сордо показали это в 1995 году. Они показали это как с помощью экспериментов, так и с помощью гауссовых расчетов.
Кинетика
Одним из примеров этого является хелетропическая реакция 1,3-диенов с диоксидом серы. Химики внимательно изучили кинетику этой реакции. В 1976 году Айзекс и Лайла измерили кинетические коэффициенты для присоединения диоксида серы к производным бутадиена. Скорость присоединения контролировалась в бензоле при 30 °C при начальном двадцатикратном избытке диена. Они использовали спектрофотометр для изучения света при 320 нм, чтобы измерить исчезновение SO2. Реакция показала "кинетику псевдо первого порядка". Химики обнаружили, что электроноотнимающие группы на диене снижают скорость реакции. Кроме того, на скорость реакции значительно влияли стерические эффекты 2-заместителей, причем более громоздкие группы увеличивали скорость реакции. (Другими словами, чем больше группа атомов, свисающих со второго атома углерода, тем быстрее протекала реакция). Авторы объясняют это тенденцией громоздких групп благоприятствовать цисоидной конформации диена, которая необходима для реакции (см. таблицу ниже). Кроме того, для семи диенов были измерены скорости при четырех температурах. На основании этих измерений химики использовали уравнение Аррениуса для расчета энтальпии активации (ΔH‡) и энтропии активации (ΔS‡) для каждой реакции. Это была одна из первых важных попыток изучить кенетику хелетропической реакции.
| -Бутадиен | 104 к /мин−1 (30 °C) (± 1-2%) абсолютный | 104 к /мин−1 (30 °C) (± 1-2%) отн. | ΔH‡ /ккал моль−1 | ΔS‡ / ккал моль−1 К −1 |
| 2-метил | 1.83 | 1.00 | 14.9 | -15 |
| 2-этил | 4.76 | 2.60 | 10.6 | -20 |
| 2-изопропил | 13.0 | 7.38 | 12.5 | -17 |
| 2-терт-бутил | 38.2 | 20.8 | 10.0 | -19 |
| 2-неопентил | 17.2 | 9.4 | 11.6 | -18 |
| 2-клоро | 0.24 | 0.13 | Н/Д | Н/Д |
| 2-бромэтил | 0.72 | 0.39 | Н/Д | Н/Д |
| 2-п-толил | 24.7 | 13.5 | 10.4 | -19 |
| 2-фенил | 17.3 | 9.45 | Н/Д | Н/Д |
| 2-(п-бромфенил) | 9.07 | 4.96 | Н/Д | Н/Д |
| 2,3-диметил | 3.54 | 1.93 | 12.3 | -18 |
| цис-1-метил | 0.18 | 0.10 | Н/Д | Н/Д |
| транс-1-метил | 0.69 | 0.38 | Н/Д | Н/Д |
| 1,2-диметилен-циклогексан | 24.7 | 13.5 | 11.4 | -16 |
| 2-метил-1,1,4,4-d4 | 1.96 | Н/Д | Н/Д | Н/Д |
Моннат, Вогель и Сордо в 2002 году измерили кинетику присоединения диоксида серы к 1,2-диметилиденциклоалканам. Они написали, что реакция 1,2-диметилиденциклогексана с диоксидом серы может давать два различных продукта в зависимости от условий реакции. При кинетическом контроле (≤ -60 °C) в результате реакции образуется соответствующий сультин по реакции гетеро-Дильса-Альдера, а при термодинамическом контроле (≥ -40 °C) в результате реакции образуется соответствующий сульфолен по хелетропической реакции. Энтальпия активации для реакции гетеро-Дильса-Альдера примерно на 2 ккал/моль меньше, чем для соответствующей хелетропической реакции. Сульфолен примерно на 10 ккал/моль стабильнее изомерного сульфина в растворе CHCl/SO222.
Авторы смогли экспериментально разработать закон скорости при 261,2 К для реакции 1,2-диметилиденциклогексана с диоксидом серы с получением соответствующего сульфолена. Реакция была первого порядка в 1,2-диметилиденциклогексане, но второго порядка в диоксиде серы (см. ниже). Это подтвердило предсказание химиков-теоретиков, основанное на высокоуровневых квантовых расчетах ab initio. Используя вычислительные методы, авторы предложили переходную структуру для хелетропической реакции 1,2-диметилиденциклогексана с диоксидом серы (см. рисунок справа). Реакция имеет второй порядок по диоксиду серы, поскольку другая молекула диоксида серы, вероятно, связывается с переходным состоянием, помогая стабилизировать его. Аналогичные результаты были получены в исследовании 1995 года Суареса, Сордо и Сордо, которые использовали расчеты ab initio для изучения кинетического и термодинамического контроля реакции диоксида серы с 1,3-диенами.
d [ ]3 d t = k [ 2]1 [ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}
Влияние растворителей
Влияние растворителя на реакцию хелетропирования 3,4-диметил-2,5-дигидротиофен-1,1-диоксида (показан справа) было кинетически исследовано в 14 растворителях. Было обнаружено, что константы скорости прямой и обратной реакции, а также константы равновесия линейно коррелируют со шкалой полярности растворителя ET(30).
Реакции проводились при 120 °C и изучались с помощью 1H-ЯМР-спектроскопии реакционной смеси. Было обнаружено, что скорость прямой реакции k1 уменьшается в 4,5 раза при переходе от циклогексана к метанолу. Было обнаружено, что обратная скорость k-1 увеличивается в 53 раза при переходе от циклогексана к метанолу, а константа равновесия Keq уменьшается в 140 раз. Предполагается, что в процессе активации происходит изменение полярности, о чем свидетельствуют соотношения между равновесными и кинетическими данными. Авторы говорят, что на реакцию, по-видимому, влияет полярность растворителя, и это можно показать по изменению дипольных моментов при переходе от реактанта к переходному состоянию и продукту. Авторы также утверждают, что на хелетропическую реакцию не влияет ни кислотность, ни основность растворителя.
Результаты этого исследования позволяют авторам ожидать следующих моделей поведения:
1. Изменение полярности растворителя влияет на скорость меньше, чем равновесие.
2. Константы скорости будут характеризоваться противоположным влиянием полярности: k1 будет незначительно уменьшаться с увеличением ET(30), а k-1 будет увеличиваться при тех же условиях.
3. Эффект на k-1 будет больше, чем на k1.

Реакция 1,2-диметилиденциклогексана с SO2 дает сультин через реакцию Гетеро-Дильса-Альдера под кинетическим контролем или сульфолен через хелетропную реакцию под термодинамическим контролем

Предполагаемое переходное состояние для реакции 1,2-диметилиденциклогексана с SO2 для получения сульфолена через хелетропную реакцию
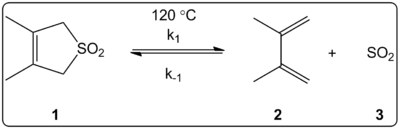
Хелетропная реакция изучена в различных растворителях
Присоединение карбенов к алкенам
Одной из наиболее важных в синтетическом отношении хелетропических реакций является присоединение синглетного карбена к алкену для получения циклопропана (см. рисунок слева). Карбен - это нейтральная молекула, содержащая двухвалентный углерод с шестью электронами в валентной оболочке. Благодаря этому карбены являются высокореакционными электрофилами и образуются в качестве промежуточных продуктов реакции. Синглетный карбен содержит пустую p-орбиталь и гибридную sp-орбиталь2 с двумя электронами. Синглетные карбены стереоспецифически присоединяются к алкенам, и стереохимия алкена сохраняется в продукте циклопропана. Механизм присоединения карбена к алкену представляет собой согласованное [2+1] циклоприсоединение (см. рисунок). Карбены, полученные из хлороформа или бромоформа, могут быть использованы для присоединения CX2 к алкену для получения дигалоциклопропана, в то время как реактив Симмонса-Смита присоединяет CH2.
Взаимодействие заполненной карбеновой орбитали с π-системой алкена создает четырехэлектронную систему и благоприятствует нелинейному подходу. Также благоприятно смешивать пустую p-орбиталь карбена с заполненной π-орбиталью алкена. Благоприятное смешивание происходит в рамках нелинейного подхода (см. рис. 2 справа). Однако, хотя теория явно отдает предпочтение нелинейному подходу, нет очевидных экспериментальных последствий для линейного и нелинейного подхода.

Присоединение карбена к алкену с образованием циклопропана

Рисунок 2. A) Орбитали для синглетных карбенов B) Нелинейное приближение a) sp-орбитали2 карбена и b) p-орбитали карбена
Вопросы и ответы
В: Что такое хелетропическая реакция?
О: Хелетропная реакция - это тип перициклической реакции, при которой один атом одного из реагентов получает две новые связи.
В: Что такое перициклическая реакция?
О: Перициклическая реакция - это реакция, которая включает переходное состояние с циклическим набором атомов и соответствующим циклическим набором взаимодействующих орбиталей, в котором происходит реорганизация َ и ً связей.
В: Чем это отличается от других типов реакций?
О: Хелетропические реакции являются подклассом циклоприсоединений, и от других типов реакций их отличает то, что в одном из реагентов обе новые связи образуются с одним и тем же атомом.
В: Каковы некоторые примеры?
О: Примеры включают "хелетропические экструзии", например, когда один атом в карбонильной группе заканчивается в монооксиде углерода.
В: Что движет этими реакциями?
О: Движущей силой этих реакций часто является энтропийная выгода от высвобождения газа (например, CO или N2).
В: Относится ли рисунок 1 к хелетропическим реакциям? О: Да, на рисунке 1 показаны примеры хелетропических реакций.
искать
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)