SN2-реакция
Реакция SN 2 (также известная как бимолекулярное нуклеофильное замещение) - это реакция замещения в органической химии. Это тип нуклеофильного замещения, при котором одиночная пара нуклеофила атакует электронодефицитный электрофильный центр и связывается с ним. При этом отщепляется другая группа, называемая "уходящей группой". Таким образом, входящая группа заменяет уходящую группу за один шаг. Поскольку в медленном, определяющем скорость реакции этапе участвуют два реагирующих вида, это приводит к названию бимолекулярного нуклеофильного замещения, или SN 2. Среди химиков-неоргаников реакция SN 2 часто известна как механизм замещения.
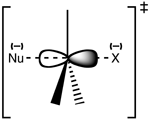
Структура переходного состояния SN 2
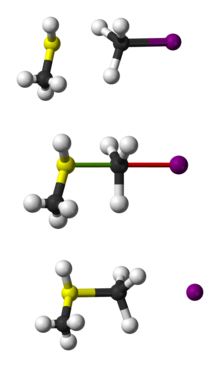
Шариково-палочковое представление SN 2 реакции CH3 SH с CH3 I
Механизм реакции
Реакция чаще всего происходит на алифатическом углеродном центре sp3 с присоединенной к нему электроотрицательной, стабильной уходящей группой - 'X' - часто атомом галоида. Разрыв связи C-X и образование новой связи C-Nu происходят одновременно, образуя переходное состояние, в котором углерод, подвергшийся нуклеофильной атаке, является пентакоординированным и приблизительно sp2 гибридизованным. Нуклеофил атакует углерод под углом 180° к уходящей группе, поскольку это обеспечивает наилучшее перекрывание между одинокой парой нуклеофила и антисвязывающей орбиталью C-X σ*. Затем уходящая группа отталкивается с противоположной стороны, и образуется продукт.
Если субстрат, подвергающийся нуклеофильной атаке, является хиральным, это может привести, хотя и не обязательно, к инверсии стереохимии, называемой инверсией Вальдена.
В примере реакции SN 2 атака OH −(нуклеофила) на бромэтан (электрофил) приводит к этанолу, при этом бромид выбрасывается в качестве уходящей группы:
Реакция SN 2 происходит, если обратный путь атаки не блокирован другими атомами в молекуле (стерически затруднен заместителями на субстрате). Таким образом, этот механизм обычно происходит на беспрепятственном первичном углеродном центре. Если на субстрате вблизи уходящей группы имеется стерическая скученность, например, на третичном углеродном центре, замещение будет происходить по механизму SN 1, а не SN 2 (SN 1 также более вероятен в случае блокированных молекул, поскольку может образоваться достаточно стабильный карбокатион-посредник).
В координационной химии ассоциативное замещение протекает по механизму, аналогичному SN 2.
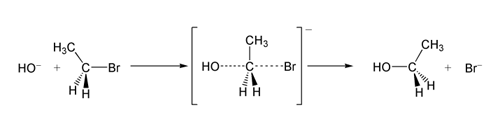
SN 2 реакция бромэтана с гидроксид-ионом.
Факторы, влияющие на скорость реакции
На скорость реакции влияют четыре фактора:
- Субстрат. Субстрат играет самую важную роль в определении скорости реакции. Это связано с тем, что нуклеофил атакует с обратной стороны субстрата, тем самым разрывая связь углерод-оставляющая группа и образуя связь углерод-нуклеофил. Поэтому, чтобы максимально увеличить скорость реакции SN 2, спинка субстрата должна быть как можно более беспрепятственной. В целом, это означает, что быстрее всего реагируют метильные и первичные субстраты, за ними следуют вторичные субстраты. Третичные субстраты не участвуют в реакции SN 2 из-за стерических препятствий.
- Нуклеофил. Как и субстрат, стерические препятствия влияют на силу нуклеофила. Например, анион метоксида является одновременно сильным основанием и нуклеофилом, потому что он является метиловым нуклеофилом и, таким образом, не имеет стерических препятствий. Терт-бутоксид, с другой стороны, является сильным основанием, но плохим нуклеофилом, поскольку три метильные группы препятствуют его подходу к углероду. На силу нуклеофила также влияют заряд и электроотрицательность: нуклеофильность возрастает с увеличением отрицательного заряда и уменьшением электроотрицательности. Например, OH- является лучшим нуклеофилом, чем вода, а I- - лучшим нуклеофилом, чем Br- (в полярных протических растворителях). В полярном апротовом растворителе нуклеофильность возрастает вверх по столбцу периодической таблицы, поскольку между растворителем и нуклеофилом нет водородной связи. В этом случае нуклеофильность является зеркальным отражением основности. Поэтому I- будет более слабым нуклеофилом, чем Br- , поскольку он является более слабым основанием.
- Растворитель. Растворитель влияет на скорость реакции, поскольку растворители могут окружать или не окружать нуклеофил, тем самым препятствуя или не препятствуя его приближению к атому углерода. Полярные апротические растворители, такие как тетрагидрофуран, являются лучшими растворителями для этой реакции, чем полярные протические растворители, потому что полярные протические растворители сольватируются за счет водородной связи растворителя с нуклеофилом. Это мешает ему атаковать углерод с уходящей группой.
- Уходящая группа. Уходящая группа влияет на скорость реакции. Чем стабильнее уходящая группа, тем больше вероятность того, что при атаке нуклеофила на углерод она примет два электрона его связи с уходящей группой. Поэтому, чем слабее уходящая группа в качестве сопряженного основания, тем лучше уходящая группа. Аналогично, чем сильнее соответствующая кислота, тем лучше уходящая группа. Примерами хороших уходящих групп являются галогениды (кроме фторидов) и тозилаты. Но HO- и H2 N- не являются хорошими уходящими группами.
Кинетика реакции
Скорость реакции SN 2 является реакцией второго порядка, поскольку определяющая скорость стадия зависит от концентрации нуклеофила, [Nu− ], а также от концентрации субстрата, [RX].
r = k[RX][Nu− ]
Это ключевое различие между механизмами SN 1 и SN 2. В реакции SN 1 нуклеофил атакует после завершения лимитирующей стадии. Но в реакции SN 2 нуклеофил вытесняет уходящую группу на лимитирующей стадии. Другими словами, скорость SN 1 реакции зависит только от концентрации субстрата, в то время как скорость SN 2 реакции зависит от концентрации субстрата и нуклеофила. В случаях, когда возможны оба механизма (например, на вторичном углеродном центре), механизм зависит от растворителя, температуры, концентрации нуклеофила или от уходящей группы.
Реакции SN 2 обычно протекают в первичных алкилгалогенидах или вторичных алкилгалогенидах с апротическим растворителем. В третичных алкилгалогенидах они протекают с незначительной скоростью из-за стерических препятствий.
SN 2 и SN 1 - это две крайние точки скользящей шкалы реакций. Можно найти много реакций, в механизмах которых проявляется как SN 2, так и SN 1 характер. Например, можно получить контактные ионные пары, образованные из алкилгалогенида, в которых ионы не полностью разделены. Когда они подвергаются замещению, стереохимия будет инвертирована (как в SN 2) для многих реагирующих молекул, но некоторые из них могут сохранять конфигурацию. Реакции SN 2 встречаются чаще, чем реакции SN 1.
E2 соревнование
Обычной побочной реакцией, происходящей в реакциях SN 2, является элиминирование E2: входящий анион может действовать как основание, а не как нуклеофил, удаляя протон и приводя к образованию алкена. Этот эффект можно продемонстрировать на примере газофазной реакции между сульфонатом и простым бромистым алкилом, протекающей в масс-спектрометре:

При использовании бромистого этила продуктом реакции является преимущественно продукт замещения. При увеличении стерических препятствий вокруг электрофильного центра, как в случае с изобутилбромидом, замещение становится менее предпочтительным, и преобладающей реакцией является элиминирование. Другим фактором, благоприятствующим элиминированию, является сила основания. С менее основным бензоатным субстратом изопропилбромид реагирует с 55% замещения. В целом, реакции в газовой фазе и реакции в растворе такого типа протекают одинаково, хотя в первом случае влияние растворителя отпадает.
Механизм кругового движения
Разработка, привлекшая внимание в 2008 году, касается кругового механизма SN 2, наблюдаемого в газофазной реакции между хлорид-ионами и йодистым метилом с помощью специальной техники, называемой визуализацией скрещенных молекулярных пучков. Когда ионы хлорида имеют достаточную скорость, энергия образующихся ионов йодида после столкновения намного ниже, чем ожидалось, и предполагается, что энергия теряется в результате полного обхода метильной группы вокруг атома йода до того, как произойдет фактическое смещение.
Похожие страницы
- Реакция замещения
- SN 1 реакция
Вопросы и ответы
В: Что такое реакция SN2?
О: Реакция SN2 - это реакция замещения в органической химии, в которой нуклеофил атакует электронодефицитный электрофильный центр, вытесняя уходящую группу, а затем замещает ее в один этап.
В: К какому типу реакций замещения относится реакция SN2?
О: Реакция SN2 - это один из видов реакции нуклеофильного замещения.
В: Сколько видов реагирующих веществ участвует в медленной, определяющей скорость реакции SN2?
О: В медленной, определяющей скорость реакции SN2 участвуют два реагирующих вида.
В: Что означает название "бимолекулярное нуклеофильное замещение" для реакции SN2?
О: Название "бимолекулярное нуклеофильное замещение" для реакции SN2 относится к тому факту, что в медленном, определяющем скорость шаге реакции участвуют два реагирующих вида.
В: Что такое нуклеофил в контексте реакции SN2?
О: Нуклеофил - это молекула или ион, который отдает одинокую пару электронов для образования химической связи.
В: Что такое электрофил в контексте реакции SN2?
О: Электрофил - это молекула или ион, который принимает пару электронов для образования химической связи.
В: Как реакция SN2 часто называется среди химиков-неоргаников?
О: Среди химиков-неоргаников реакция SN2 часто известна как механизм взаимообмена.
искать